- Головна сторінка
- Про себе
- Рецепти на кожен день
- Для Вас батьки
- Критерії оцінювання
- Досягнення
- Кабінет хімії
- Планування: хімія, "Пізнаємо природу"
- Підручники
- Всеукраїнський конкурс "Кристали"
- Природознавство: навчальні відео
- Хімія: навчальні відео
- Навчальні проекти
- Проекти з природознавства
- Учнівські проекти 8 клас
четвер, 31 березня 2016 р.
Морський бій на таблиці Менделєєва
 Проект «Розвиток дитини» пропонує школярам та вчителям хімії гру «Морський бій на таблиці Менделєєва», що є чудовою можливістю вивчити Періодичну систему хімічних елементів.
Проект «Розвиток дитини» пропонує школярам та вчителям хімії гру «Морський бій на таблиці Менделєєва», що є чудовою можливістю вивчити Періодичну систему хімічних елементів.Гра містить чотири сторінки із таблицею Менделєєва — по дві сторінки на кожного гравця. Кожному гравцю на одній таблиці необхідно намалювати свої кораблі, а на іншій — позначати крапками свої постріли та підбиті кораблі супротивника.
Завдання сприятиме вивченню назв хімічних елементів, їх атомних мас та порядкових номерів у таблиці.
Всі сторінки для гри у морський бій на таблиці Менделєєва можна роздрукувати на звичайному або кольоровому принтері та використовувати необмежену кількість разів.
Завантаження доступне безкоштовно для користувачів сайту «Розвиток дитини» після швидкої реєстрації.
середу, 30 березня 2016 р.
понеділок, 28 березня 2016 р.
До уваги 7-их класів
1. Виконайте тести з теми
"Прості речовини. Оксиген. Кисень"
2. Закінчити рівняння хімічних реакцій:
"Прості речовини. Оксиген. Кисень"
2. Закінчити рівняння хімічних реакцій:
Аl + Br2 → Zn + О2 → Nа + S →
K + О2 → АІ + S → Zn + F2→
Р + О2 → S + О2 → С + О2 →
Zn+ СІ2 → Pb + О2 → Са + О2 →
Fе + О2 → Mg + S → Al + СІ2 →
Р + Н2 → АІ + О2 → N2 + Н2 →
Fе + S → Nа + СІ2 → Mg+ О2 →
неділю, 27 березня 2016 р.
суботу, 19 березня 2016 р.
Флеш-анімації з хімії
 До уваги учнів!
До уваги учнів! Готуючись до уроків, використовуйте "Флеш-анімації". Це вам допоможе.
середу, 16 березня 2016 р.
Хімія у побуті
Пластиковий посуд: більше користі чи шкоди?
Нині неможливо уявити бодай один день нашого життя без целофану,
різноманітних полімерних упаковок, пластикових контейнерів, одноразового посуду
та інших досягнень цивілізації. Вони значно полегшують наш побут, проте, вибір
матеріалів з полімерів, представлений на сучасному ринку, доволі великий і не
всі із них безпечні для нашого організму, особливо якщо систематично
використовувати таку тару не за призначенням.
Так, одні полімери виділяють токсини при контакті з кислотами та спиртним,
інші – не витримують високих температур тощо. І хоча миттєве гостре отруєння
Вам не загрожує, використання неякісного посуду згодом обов’язково призведе до
появи певних хвороб, адже в організмі відбувається поступове накопичення
токсичних речовин. Щоб уникнути біди, варто розібратися в особливостях
застосування різноманітного посуду.
вівторок, 15 березня 2016 р.
Запах повітря
після дощу
Всім добре відомо як незвично пахне повітря
після грози. Цей запах обумовлений утворенням під час електричних розрядів
озону, який недарма в перекладі з грецького означає «пахучий». Характерний
запах озону не сплутати ні з чим - він пахне свіжістю.
Озоном називається проста речовина, яка
складається з трьох атомів кисню. Молекулярна формула – O3,
молекулярна маса 48, що важче за кисень в 2,5 рази. Молекула О3
нестійка і при достатніх концентраціях у повітрі, за нормальних умов,
мимовільно за кілька десятків хвилин перетворюється на O2 з
виділенням тепла.
2О3
= 3О2 + Q
Детальныше>>
понеділок, 14 березня 2016 р.
Хімічні властивості кистю
До уваги 7-их класів!

Готуючись до уроку
1. Виконайте тест "Прості речовини. Оксиген. Кисень. Повітря."
тест тут
2. Перегляньте дані відео:
Склад повітря
Горіння сірки у кисні

Готуючись до уроку
1. Виконайте тест "Прості речовини. Оксиген. Кисень. Повітря."
тест тут
2. Перегляньте дані відео:
Склад повітря
Горіння сірки у кисні
Горіння фосфору у кисні
Горіння вуглецю
Горіння амоніаку в кисні
пʼятницю, 11 березня 2016 р.
Ми за здоровий спосіб життя!
20 причин полюбити банани
Банани смачні. Але це не єдина їхня принада. Існує щонайменше 20 причин полюбити їх. Не вірите? Читайте …
четвер, 10 березня 2016 р.
До уваги 9-Б класу!
Підготовка до самостійної роботи
1. Розв'яжіть задачі.
Поняття про хімічну кінетику. Швидкість хімічних реакцій. Залежність швидкості реакції від концентрації реагуючих речовин. Закон діючих мас.
Детальніше >>
Підготовка до самостійної роботи
1. Розв'яжіть задачі.
1.
Швидкість реакції при температурі 00 С дорівнює 3 моль/л
с. Обчислити швидкість цієї реакції при температурі 400С, якщо
температурний коефіцієнт швидкості реакції 2.
2.
Швидкість реакції при охолодженні від 500
до 300 С зменшилася в 16 разів. Знайти температурний коефіцієнт
швидкості реакції.
3.
Обчисліть швидкість реакції, якщо відомо, що концентрація вихідних речовини
змінилася від 0,7 моль/л до 0,4 моль/л
за 30 секунд.
4. Обчисліть початкову швидкість хімічної реакції, що відбувається за рівнянням: С2Н4 + 3О2 = 2СО2↑ + 2Н2О. Концентрація С2Н4 – 2,5 моль/л, а О2 – 3 моль/л. Константа швидкості реакції дорівнює 0,5.
5. Як зміниться швидкість реакції 4NH3 + 5О2 = 4NО + 6H2О, якщо
тиск системи збільшити у 2 рази?
2. Перегляньте конспектПоняття про хімічну кінетику. Швидкість хімічних реакцій. Залежність швидкості реакції від концентрації реагуючих речовин. Закон діючих мас.
Детальніше >>
середу, 9 березня 2016 р.
До уваги 10-го класу
Тема. Лужноземельні елементи та Магній.
Тема. Лужноземельні елементи та Магній.
1. Загальна характеристика лужноземельних елементів.
•на зовнішньому енергетичному
рівні знаходиться два s-електрони;
•вища валентність в оксидах,
гідроксидах та солях — II;
•ступінь окиснення у сполуках —
+2;
• подібно до лужних елементів є
сильними відновниками, крім Берилію;
•у природі знаходяться у
вигляді сполук;
•мають невисокі густину і
твердість.
2. Біологічна роль.
У середньому в організмі дорослої людини міститься
близько 1 кг Кальцію.
Приблизно
99 % цієї кількості входить до складу кальцій фосфату, що знаходиться в кісткових та зубних
тканинах. Без
Кальцію неможливе згортання крові, скорочення м'язів і функціонування нервової
системи. Засвоєнню
цього елемента в організмі сприяє наявність вітаміну D, нестача якого у дитячому віці може викликати рахіт.
Кальцій, як і Натрій та Калій, також відіграє важливу роль у гомеостазі.
Магній є необхідним для правильного функціонування м'язів і нервової системи. У середньому в дорослої людини його міститься всього 25 г, більша частина якого сконцентрована в кістках. До організму Магній потрапляє із зеленим листям овочів, оскільки воно містить хлорофіл — комплексну сполуку, центральним атомом якої є Магній.
Магній є необхідним для правильного функціонування м'язів і нервової системи. У середньому в дорослої людини його міститься всього 25 г, більша частина якого сконцентрована в кістках. До організму Магній потрапляє із зеленим листям овочів, оскільки воно містить хлорофіл — комплексну сполуку, центральним атомом якої є Магній.
«Барієва каша» використовується для рентгеноскопічної
діагностики хвороб шлунково-кишкового тракту.
3. Хімічні властивості лужноземельних металів.
1) Робота зі схемою.
Оскільки в підгрупі зі зростанням протонного числа
зверху вниз зростає радіус атома, то хімічна активність металічних елементів
зростає від Мg до Ва.
З усіх
металів II групи головної підгрупи хімічна активність магнію є найнижчою. Тому з водою він
реагує при нагріванні, утворюючи магній оксид, а не гідроксид:
Mg + H2O → MgO
+ H2↑
На відміну від металів II групи, берилій не взаємодіє з воднем і не
утворює гідриду.
4. Домашнє
завдання
1.Дайте характеристику Кальцію
за положенням у періодичній системі та будовою атома.
2.Напишіть рівняння реакцій
взаємодії стронцію з речовинами, поданими у схемі.
3.Як із кальцій карбонату можна
добути кальцій оксид? Напишіть відповідні рівняння реакцій.
4.У періодичній системі Кальцій
знаходиться біля Калію, але його хімічні властивості є більш подібними до
Натрію, який міститься у II періоді. Чому?
неділю, 6 березня 2016 р.
До уваги учнів 9-Б класу
Домашнє завдання.
1. Реакція за температури 40ºC проходить за 2 хвилини 15 секунд. За який час закінчиться ця реакція за температури 60ºC, якщо температурний коефіцієнт швидкості реакції дорівнює 3?
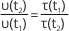
2. Визначте середню швидкість реакції, якщо відомо, що вихідна концентрація однієї з реагуючих речовин становила 1 моль/ л, а через 4 с реакції вона дорівнювала 0,6 моль/л.
1. Реакція за температури 40ºC проходить за 2 хвилини 15 секунд. За який час закінчиться ця реакція за температури 60ºC, якщо температурний коефіцієнт швидкості реакції дорівнює 3?
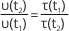
3. Як зміниться швидкість реакції, температурний коефіцієнт якої 4, при підвищенні температури з 40 до 70° С?
4. При 50 °С реакція відбувається за 4 хвилини. Скільки часу буде відбуватися ця реакція при 80 °С? Температурний коефіцієнт становить 2.
5. Визначте температурний коефіцієнт реакції, якщо при підвищенні температури з 20 до 60° С її швидкість збільшилась у 256 разів.
5. Визначте температурний коефіцієнт реакції, якщо при підвищенні температури з 20 до 60° С її швидкість збільшилась у 256 разів.
VII Міжнародний конкурс школярів “Від кристалів-гігантів до нанокристалів”
Увага! Приймаємо участь у конкурсі!
VII Міжнародний конкурс школярів “Від кристалів-гігантів до нанокристалів” проводиться у два етапи:
I – заочний етап – з 11 січня 2016 року до 30 квітня 2016 року;
ІІ – очний етап – 14 травня 2016 року.
У конкурсі беруть участь учні 1-11 класів загальноосвітніх навчальних закладів та вихованців позашкільних навчальних закладів області, а також можуть брати школярі інших областей України. До участі у конкурсі запрошуються учні загальноосвітніх навчальних закладів Польщі та інших країн, з якими укладені угоди.
Для участі у конкурсі необхідно: читати тут
I – заочний етап – з 11 січня 2016 року до 30 квітня 2016 року;
ІІ – очний етап – 14 травня 2016 року.
У конкурсі беруть участь учні 1-11 класів загальноосвітніх навчальних закладів та вихованців позашкільних навчальних закладів області, а також можуть брати школярі інших областей України. До участі у конкурсі запрошуються учні загальноосвітніх навчальних закладів Польщі та інших країн, з якими укладені угоди.
Для участі у конкурсі необхідно: читати тут
суботу, 5 березня 2016 р.
Цікаві факти про воду
Матеріал до уроків природознавства та хімії (7 клас)

• В дний момент 70 % поверхні Землі покриті водою , а придатний до вживання тільки 1 % цієї води.
• 46 % всієї води Землі знаходиться в Тихому океані , в Атлантичному - 23,9 , в Індійському - 20,3 , а в Північному Льодовитому - 3,7%.
• Середня температура поверхні води світового океану дорівнює 17,4 градуси , в той час як середня температура нижнього шару повітря над світовим океаном дорівнює 14,4 градусам.
• Морська вода замерзає при температурі - 1,91 ° C.
• 85 % всіх захворювань у світі передається за допомогою води.Детальніше>>
Пізнавальні та цікаві факти про воду
Цікаві відео
1. Кругообіг води у природі
2. Властивості води
четвер, 3 березня 2016 р.
вівторок, 1 березня 2016 р.
1 березня - 147-ма річниця відкриття Періодичного закону

«…періодичному законові майбутнє
не загрожує руйнуванням,
а тільки надбудова
й розвиток передбачаються».
Д. І. Менделєєв
 1 березня 1869 року - дата відкриття Періодичного закону і створення першого варіанта періодичної системи. В цей день, на засіданні Роійського фізико-хімічного товариства, було зачитано повідомлення російського хіміка Дмитра Івановича Менделєєва про відкриття ним Періодичнрго закону хімічних елементів. В цьому ж році вийшло перше видання менделєєвського підучника "Основи хімії", в котрому була наведена його періодична таблиця.
1 березня 1869 року - дата відкриття Періодичного закону і створення першого варіанта періодичної системи. В цей день, на засіданні Роійського фізико-хімічного товариства, було зачитано повідомлення російського хіміка Дмитра Івановича Менделєєва про відкриття ним Періодичнрго закону хімічних елементів. В цьому ж році вийшло перше видання менделєєвського підучника "Основи хімії", в котрому була наведена його періодична таблиця.Коли Д.І. Менделєєву говорили, що він геній, учений відповідав: "Працював усе життя, тому і геній".
Тому бажаю усім успіхів у вивченні хімії, творчих досягнень, відкриттів, але пам'ятайте слова Д.І.Менделєєва, щоб чогось досягти потрібно багато працювати.
Підписатися на:
Дописи (Atom)











